循環腫瘤細胞(CTCs)
![]() CTC是各類循環腫瘤細胞的統稱
CTC是各類循環腫瘤細胞的統稱![]() CTC是分型與分析才具有重要臨床價值
CTC是分型與分析才具有重要臨床價值
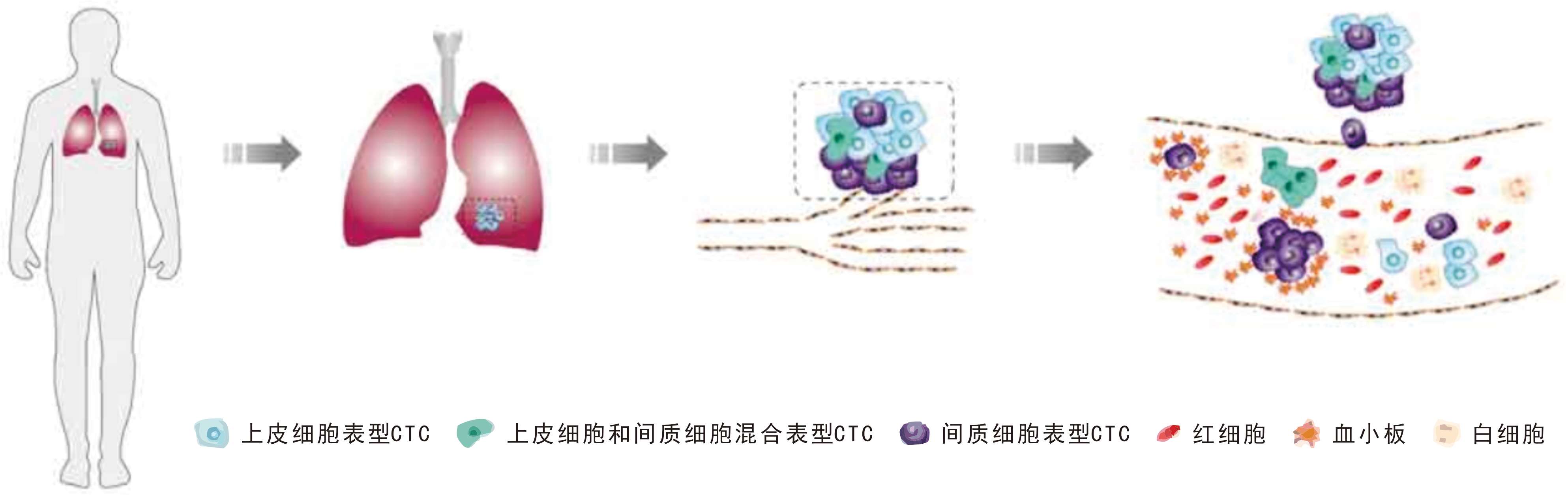
循環腫瘤細胞(CTCs,Circulating Tumor Cells)是痕量存在于外周血中的各類腫瘤細胞的統稱,因自發或診療操作從實體腫瘤病灶(原發灶、轉移灶)脫落,大部分CTCs在進入外周血后發生凋亡或被吞噬,少數能夠逃逸并錨著發展成為轉移灶【1】,增加腫瘤患者死亡風險。
大量研究表明,CTCs以不同形態存在于外周血中,既有單個存在(單細胞CTCs)、也有聚集成團(CTM,Circulating TumorMicroemboli)【2】。腫瘤細胞在進入外周血循環的過程中會發生上皮-間質轉變(EMT,EpithelIal Mesenchymal Transition),故CTCSs 存在不同細胞類型,包括上皮細胞表型、間質細胞表型和上皮細胞與間質細胞混合表型等【3】。其中,間質細胞表型CTCs具有更強的轉移潛能【4】。
CTCs的臨床價值已被廣泛肯定,但CTC的分型與分析才具有重要臨床價值。
CTC分型檢測技術![]() 納米技術與多重RNA原位分析技術的完美結合
納米技術與多重RNA原位分析技術的完美結合![]() 對所有CTC進行分離、分型、分析
對所有CTC進行分離、分型、分析
CTC分型檢測技術有機結合了納米技術和多重RNA原位分析技術的優勢,首次同步實現了各類CTCs的分離、分型和分析,具有靈敏特異、全面精準的特點【5】。CTC分型檢測技術不僅為腫瘤治療的實時監測提供了技術可能,還克服了臨床腫瘤個體化治療靶標檢測普遍面臨的樣本局限,揭開了實時腫瘤個體化治療新篇章。
在腫瘤確診后、手術前、手術后及每個治療周期的間歇期進行CTC分型檢測,能夠全面、實時地反映CTCS數量及類型的變化,可用于監測腫瘤動態、評估治療效果。通過進一步分析CTC的基因信息,可以指導制定實時個體化治療策略。
CTC分離![]() 不依賴特定生物標志物的分離技術
不依賴特定生物標志物的分離技術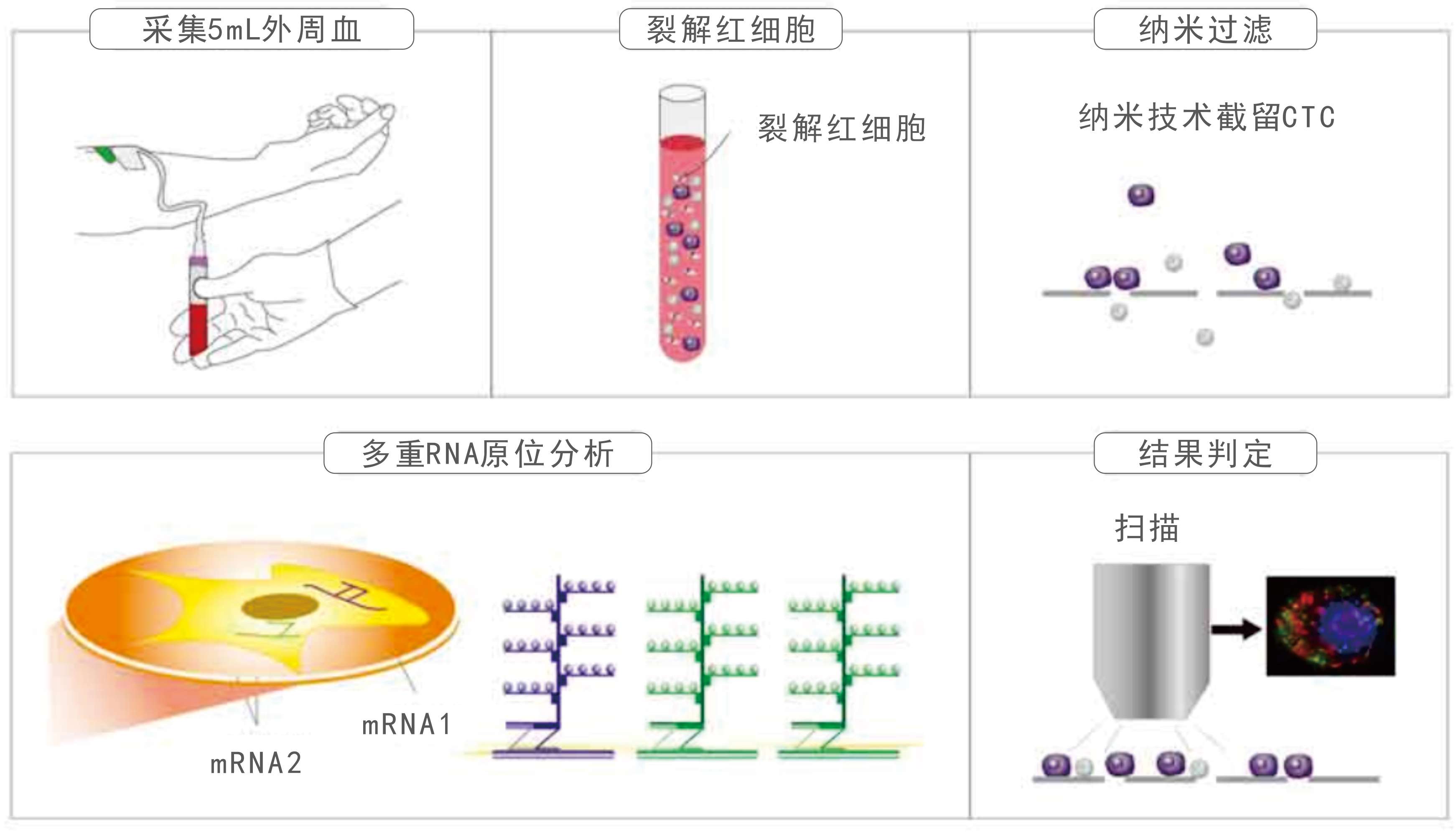
CTC分型![]() 多重RNA原位分析技術
多重RNA原位分析技術![]() 精確分型并能深入開展亞型分析
精確分型并能深入開展亞型分析
CTCs在形態學上可以分為單細胞CTC和細胞團CTM,在細胞學上可以分為上皮型CTCs和間質型CTCs。CTC分型檢測技術運用多重RNA原位分析技術,檢測靈敏度和分型特異性分別在98%和99%以上,可以同步準確識別以上全部類型的CTCs【5】。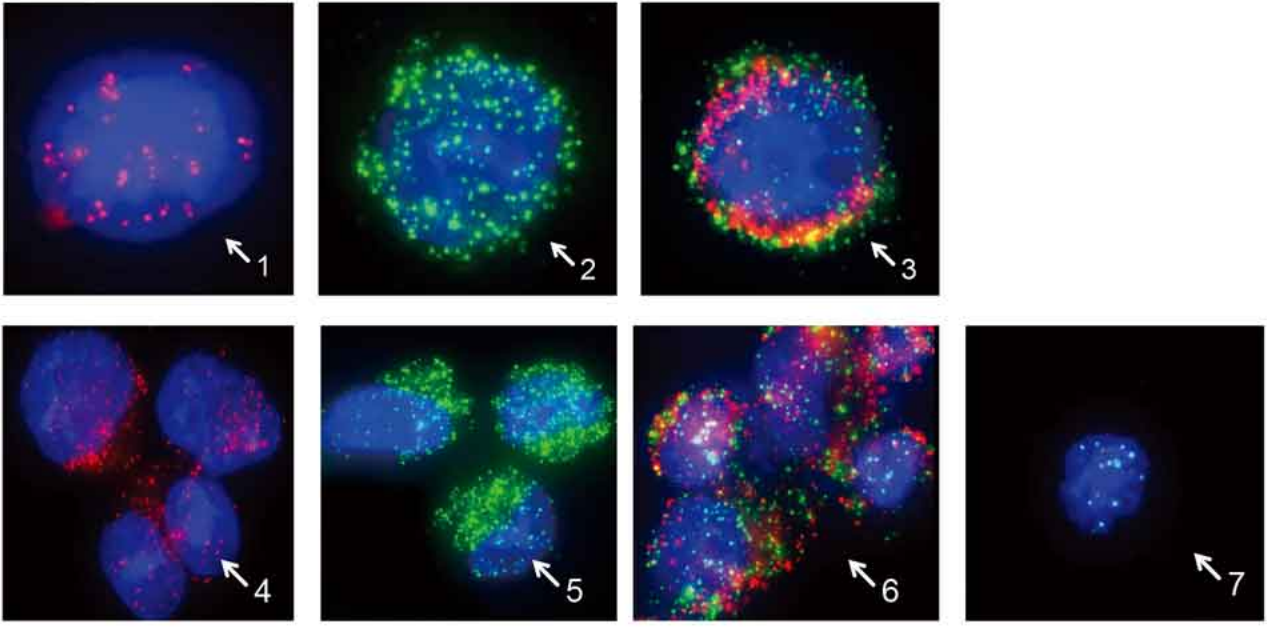
1、上皮細胞表型CTC;2、間質細胞表型CTC;3、上皮細跑和間質細胞混合表型CTC;4、上皮細胞表型CTM;5、間質細胞表型CTM;6、上皮細胞和間質細胞混合表型CTM;
7、白細胞;紅色熒光點∶上皮細胞標記物;綠色熒光點∶間質細胞標記物;藍色熒光點∶白細胞標記物。
CTC分析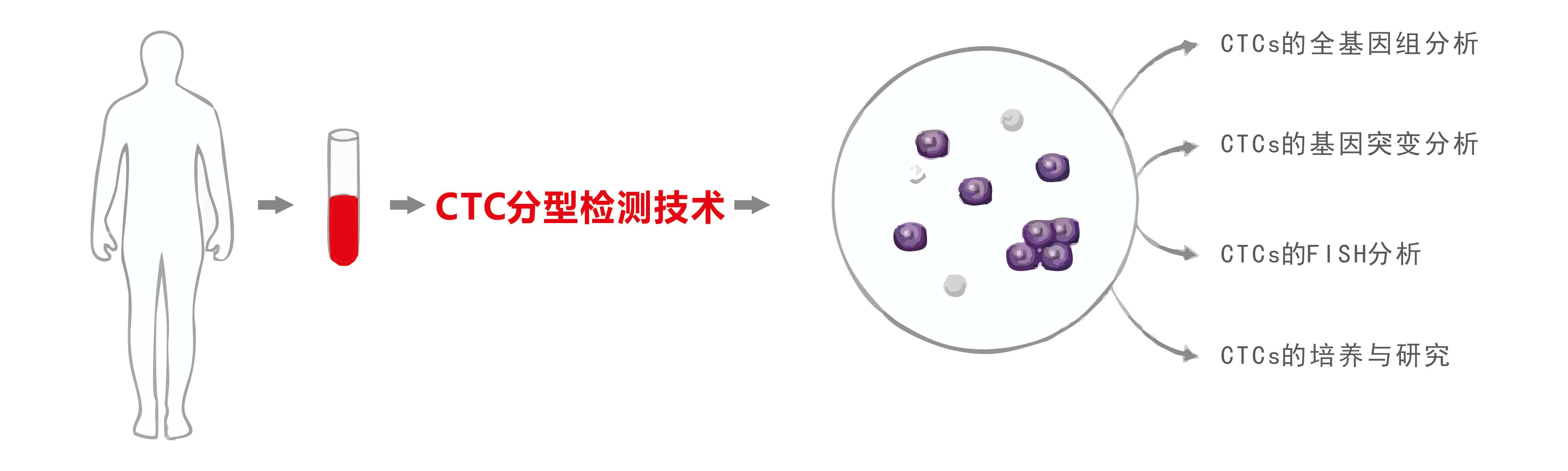
CTC分型檢測技術與一代技術對比![]() 更全面、更精準、更可靠
更全面、更精準、更可靠
CTC分型檢測技術不但克服了一代技術只能分離獲得某一特定表型CTC的缺陷,實現了對所有CTCs的分離,同時還具備了對CTCs進行全面分型和分析的能力。
| 一代技術 | CanPatrol? CTC分型檢測技術 | ||
| 方法 | 免疫捕獲法 | 納米技術結合多重RNA原位分析 | |
| 原理 | 1.運用抗體與CTCs表面特異抗原結合的生物學原理; | 1.納米技術結合多重RNA原位分析 | |
| CTCs分離 | 總回收率 | 26%-85% | >80% |
| CTM | 只能分離部分類型的CTM | 能分離所有類別的CTM | |
| EMT CTC | 只能分離個別類型的EMT CTC | 能分離所有類別的EMT CTCs | |
| CTCs分型 | 不能分型 | 能進行形態分型、細胞分型、分子分型 | |
| CTCs分析 | 只能分析個別類型的CTC | 能分析所有類別CTCs | |
| CTCs細胞培養 | 只能培養個別類型的CTC | 能培養所有類別的CTCs | |
CTC分型檢測的臨床應用![]() 監測腫瘤狀態
監測腫瘤狀態![]() 評估治療效果
評估治療效果![]() 實時個體治療
實時個體治療
CTC分型檢測適用所有實體腫瘤患者。僅需5m外周血,就能實現CTCs的分離和分型。CTC分型檢測能夠比影像學和血清學等現有常用檢測手段更早、更精確、更直接地反映腫瘤狀態,實現真正的腫瘤實時個體化治療。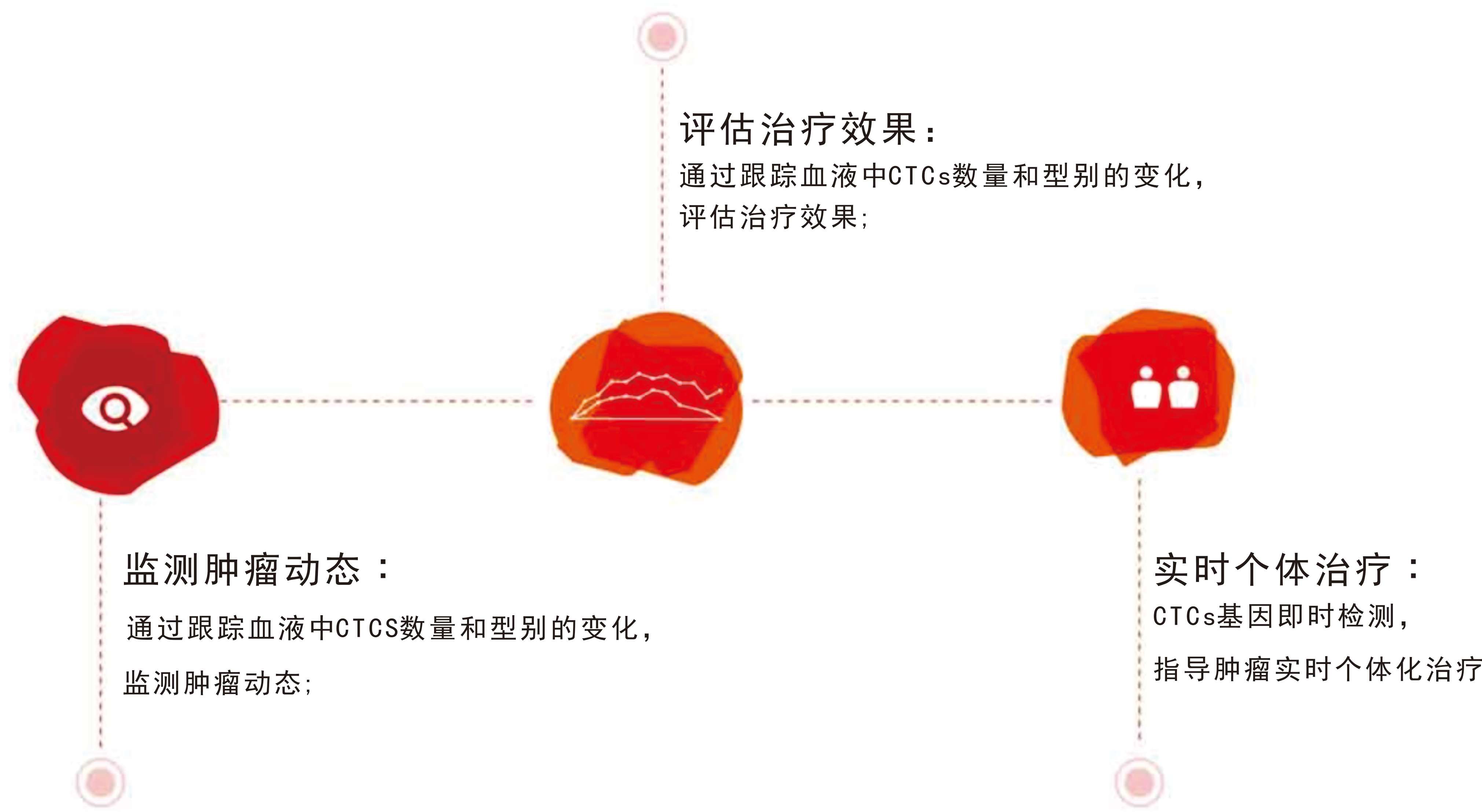
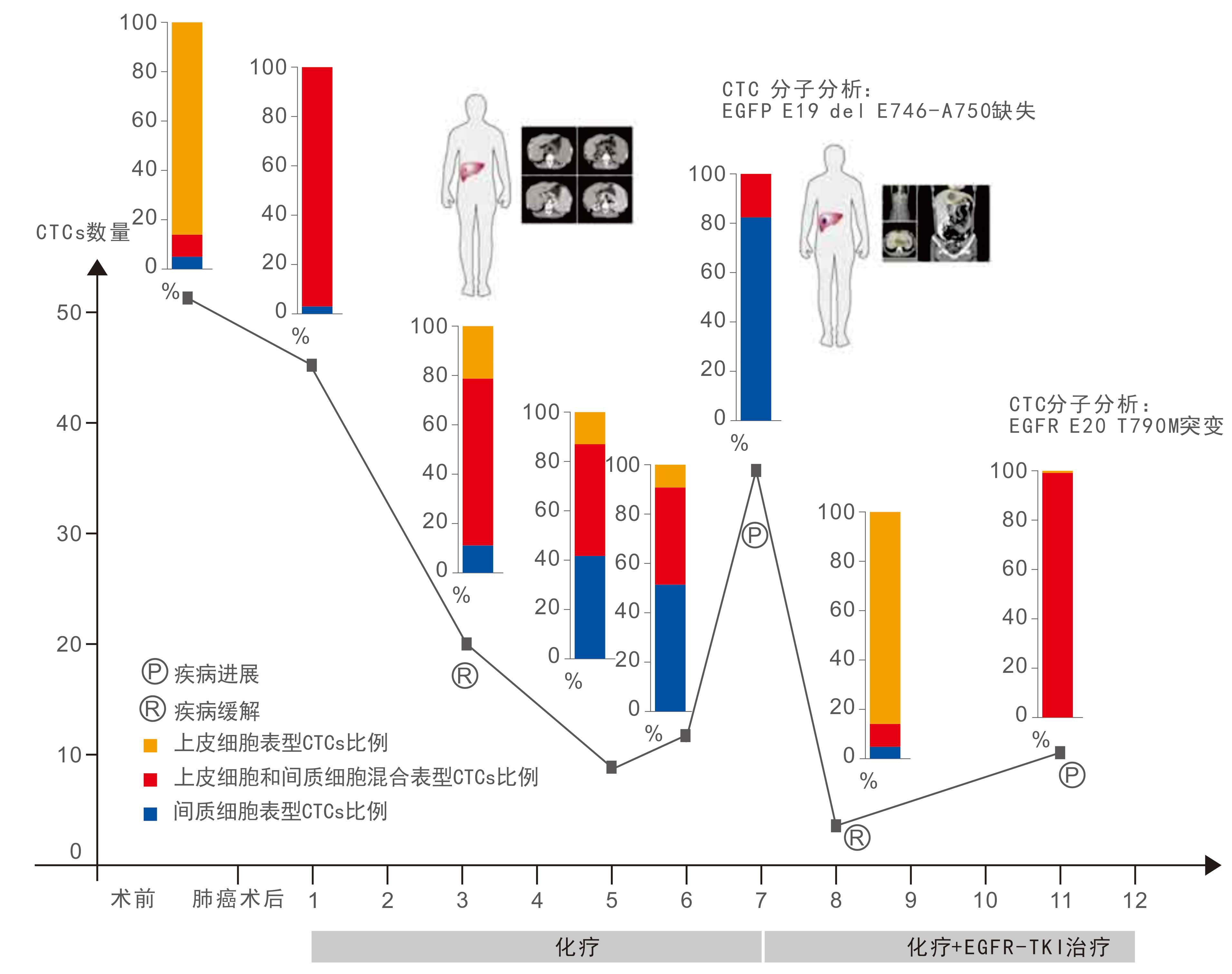
CTC的全基因組測序
CTC分型檢測分離獲得的循環腫瘤細胞,經顯微切割回收后可用于全基因組測序。對單個細胞(或少數幾個細胞)的微量全基因組DNA進行擴增,獲得高覆蓋率的完整的基因組后進行高通量測序可用于揭示細胞群體差異和細胞進化關系。多項研究表明,CTCs 的全基因組分析可以為療效評價、預后判斷以及個體化治療提供及時可靠的依據【6-7】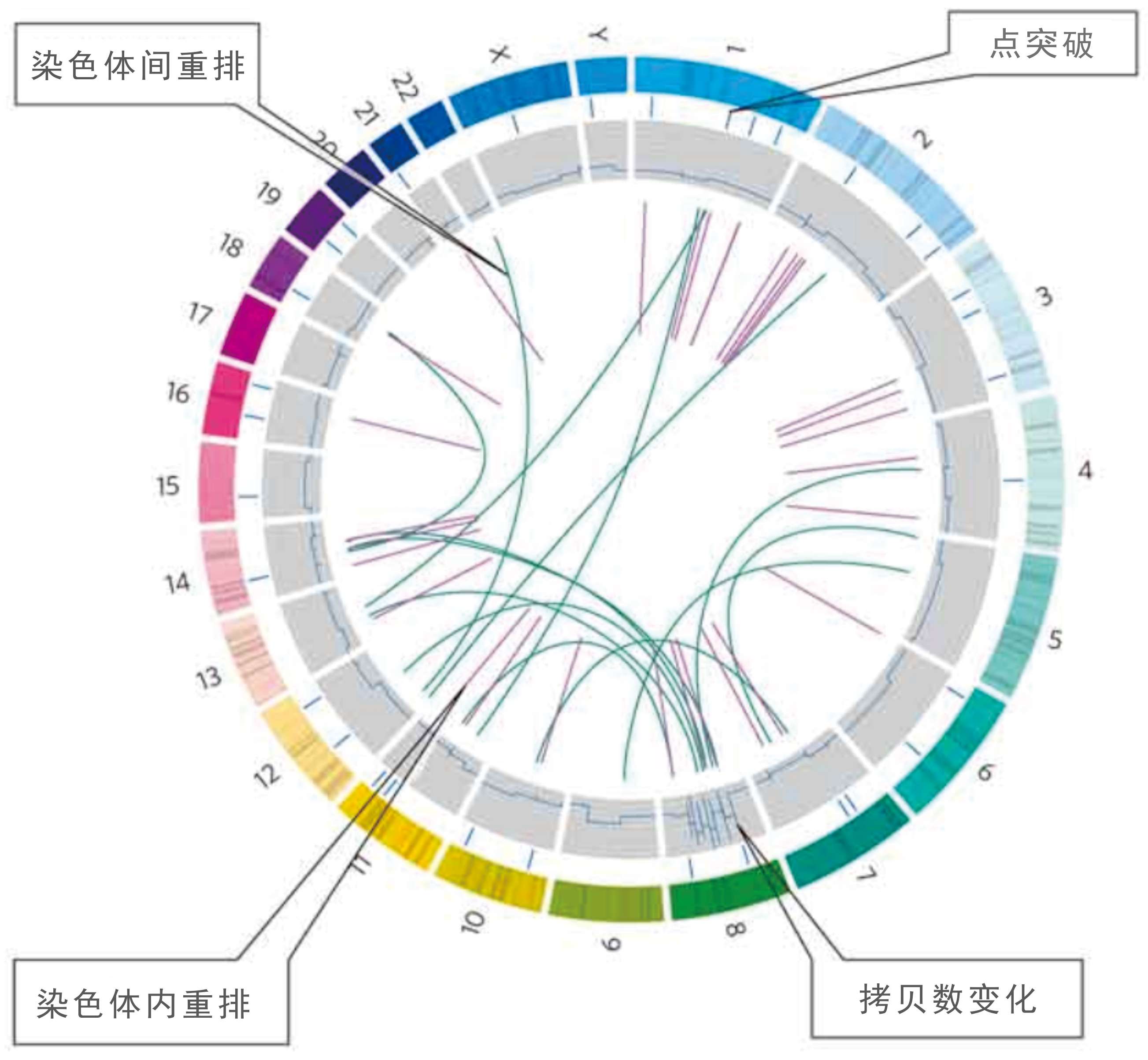
CTC的基因突變檢測
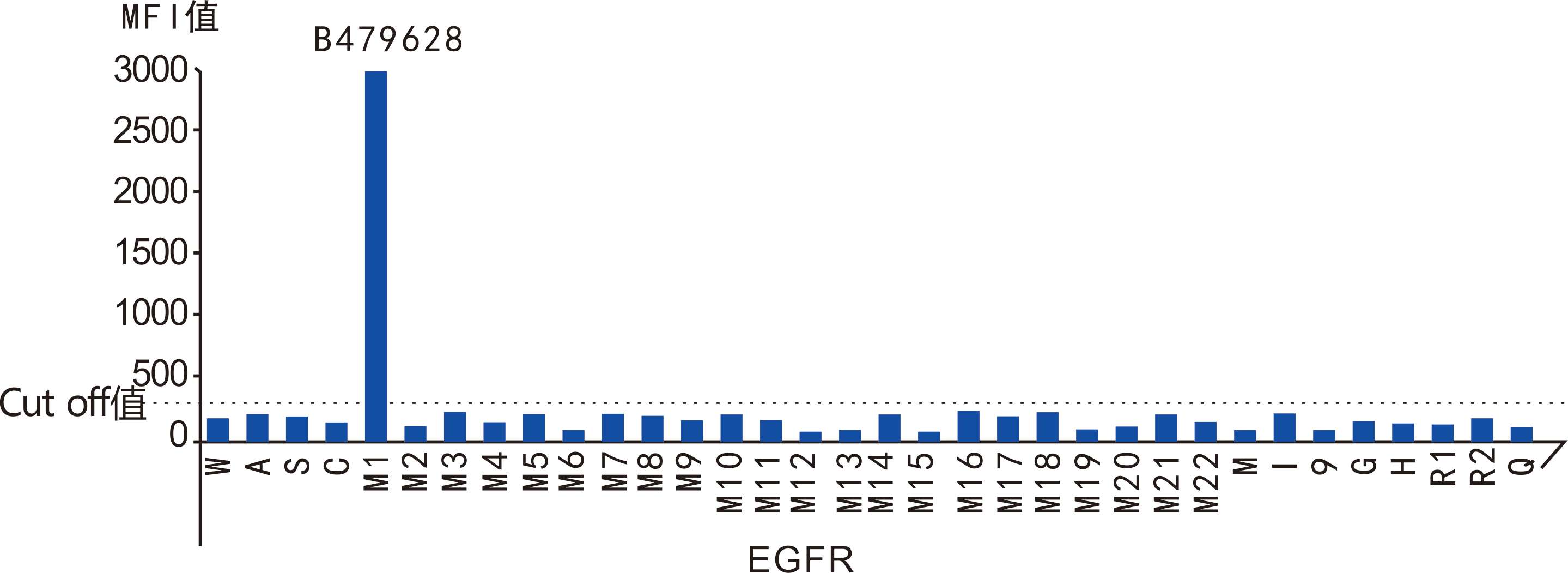
CTC分型檢測分離獲得的循環腫瘤細胞可用于基因突變檢測。大量臨床研究證實,利用CTCs進行基因突變檢測的結果與腫瘤原發灶組織高度一致【8-10】,對腫瘤患者實時個體化治療具有重要價值。CTC分型檢測還可根據需要對獲取的CTC進行單細胞基因分析。
| 樣本編號 | B31239 | B30297 | B479628 | |
| 癌種 | 結直腸癌 | 乳腺癌 | 肺癌 | |
| CTC數量 | 37個 | 19個 | 5個 | |
| 基因樣本情況 | EGFR | 陰性 | 陰性 | del E746-A750(K745:AAA) |
| KRAS | G12V | 陰性 | 陰性 | |
| BRAF | 陰性 | 陰性 | 陰性 | |
| PIK3CA | 陰性 | H1047R | 陰性 | |
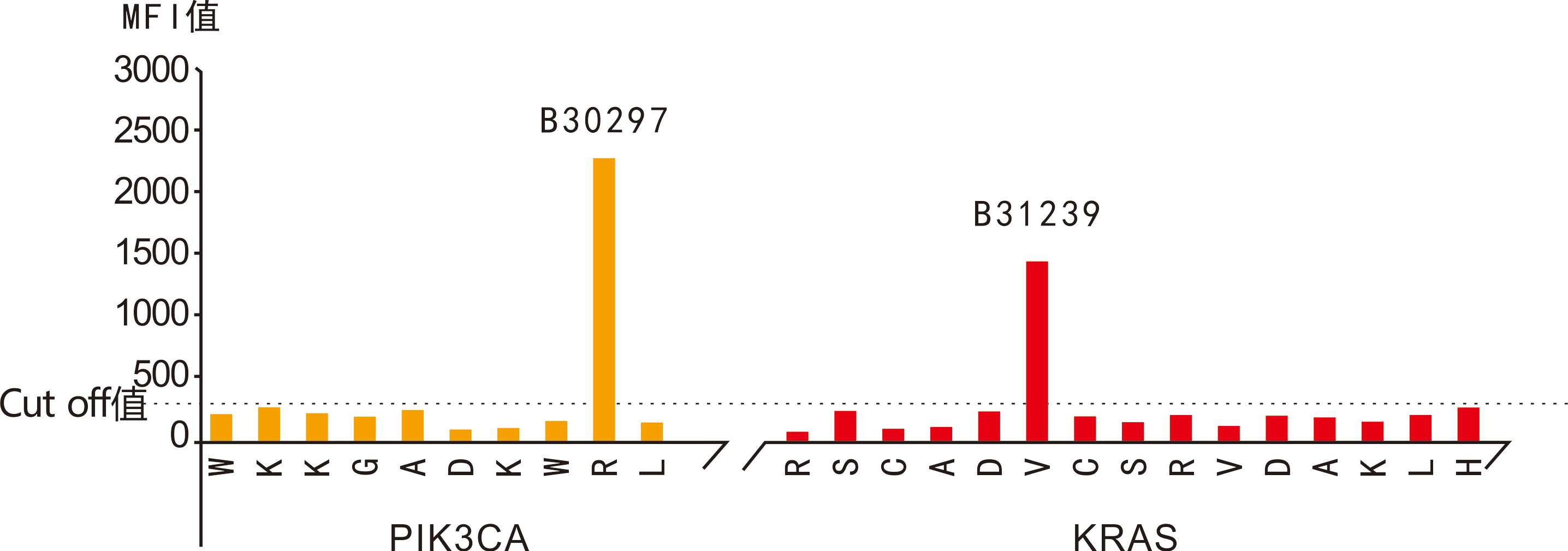
CTC的FISH檢測
CTC分型檢測分離獲得的循環腫瘤細胞可用于FISH檢測。多項研究表明,以CTCs為樣本進行FISH檢測的結果與腫瘤組織樣本檢測結果具有高度一致性【11,12】,HER2基因擴增、ALK基因重排、EGFR基因擴增、TOP2A基因擴增等項目的FISH檢測能夠預測相應藥物的療效【13,14】,為臨床治療方案的制定提供重要依據。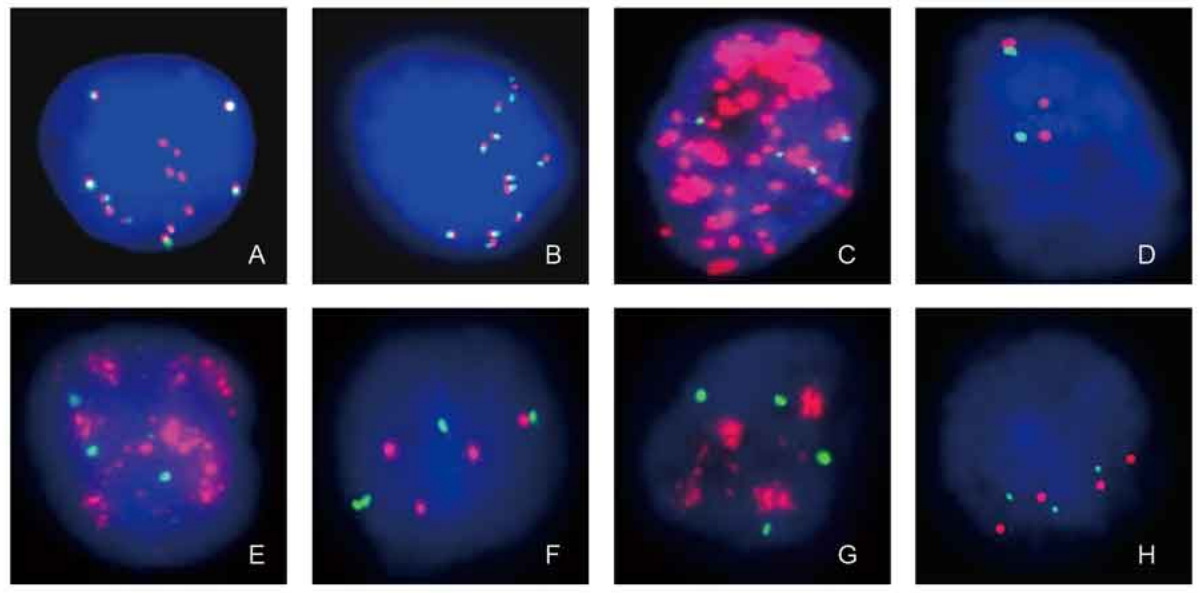
A、ALK基因重排陽性肺癌CTC;B、ALK基因重排陰性肺癌CTC;C、EGFR基因擴增陽性肺癌CTC;
D、EGFR基因擴增陰性肺癌CTC;E、HER2基因擴增陽性乳腺癌CTC;F、HER2基因擴增陰性乳腺癌CTC;G、TOP2A基因擴增陽性乳腺癌CTC;H、 TOP2A基因擴增陰性乳腺癌CTC;
CTC的培養與研究
CTC分型檢測分離獲得的循環腫瘤細胞可用于細胞培養,可供進一步的腫瘤基礎研究,如耐藥機制分析、腫瘤新藥開發、腫瘤轉移/復發風險評估模型建立等。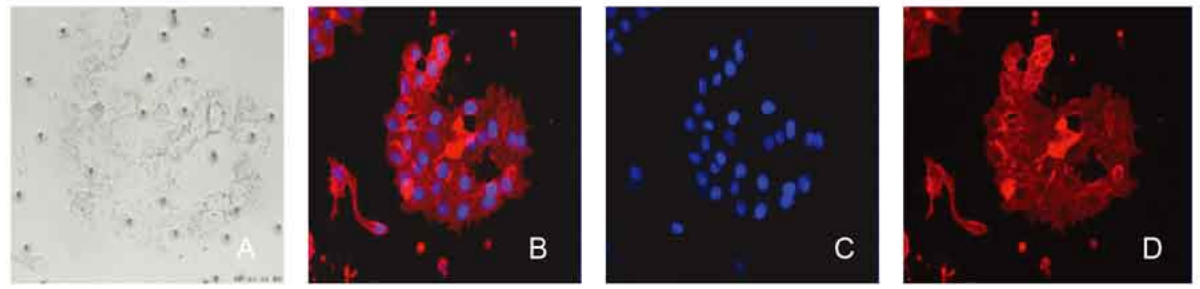
乳腺癌CTCs培養,在20X鏡下進行觀察。A明場;B.合成圖;C.DAPI;D.EpCAM-PE。
CTC分型檢測分離獲得的循環腫瘤細胞可用于干細胞檢測。腫瘤干細胞(CSC,Cancer StemCell)是腫瘤復發和形成轉移灶的根源,已有大量研究表明在乳腺癌、肺癌、肝癌等癌種中存在具有干細胞特征的CTCs【15,16】。另有研究顯示具有CSC特征的CTCs與腫瘤患者治療的耐藥性【17】、術后復發風險【18】及生存期【19】存在顯著關聯。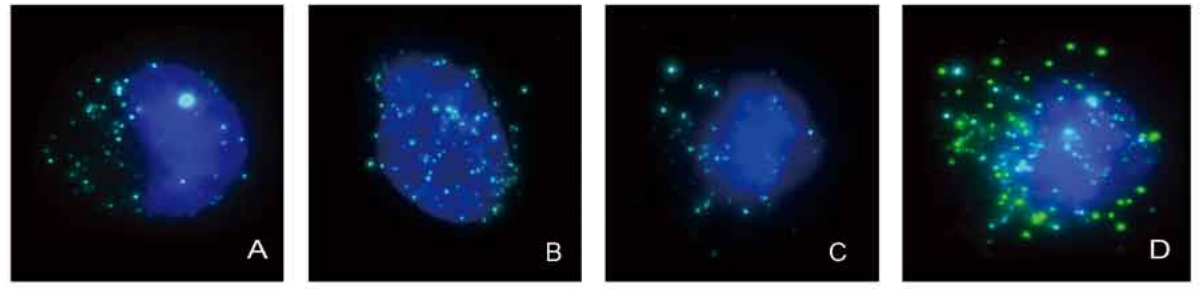
A-C∶有腫瘤干細胞標記的肺癌CTC;D∶同時具有干細胞標記和間質細胞標記的肺癌CTC。藍色;DAPl;亮藍色熒光點∶腫瘤干細胞標記物;綠色熒光點∶間質細胞標記物
參考文獻
1.Glinsky V et al.Cancer res 2003;63:3805-11. 6.Timour B et al.Nature Protocals 2012:7;1024~1041. 11.Flores L et al.Br J Cancer 2010;102:1495-502. 16.Cai X et al.Hepatoiogy 2012;56:1804-16.
2.Molnar B et al.Clin Cancer Res 2001;7:4080-5. 7.Elien H et al.Cancer Res 2013;73:2965-2975 12.Pailler E et al.J Clin Oncol 2013;31:2273-811. 17.Nadai R et al.lnt J Cancer 2013;133:2398-407.
3.Min Y et al.Sciece 2013;339:580-4. 8.Maheswaran S et al.New Engl J Med 2008;359:366-77. 13.Riethdorff S et al.Clin Cancer Res 2010;16:2634-45. 18.Fan S T et al.Ann Surg 2011;254:569-76.
4.vona G et al.Hepatology 2004;39:792-7. 9.Cristina G et al.Oncol Leff 2013;6:1343-5. 14.Rack B et al.Cancer Res 2010;70(Suppl 2):S6-S5. 19.Pilati P et al.Ann Surg Oncol 2012;19:402-8.
5.S .Wu et al.PLoS One 2015;10(4):e0123976. 10.Menoru K et al.Clin Chen 2009;55:4757-64. 15.Aktas B et al.Breast Cancer Res 2009;11:R46.
